- ENZIMAS:
El omeprazol
(5-metoxi-2-[(4-metoxi-3,5-dimetil-piridin-2-il)metilsulfinil]-3H-bencimidazol) se utiliza en el tratamiento de ladispepsia, úlcera péptica, enfermedades por reflujo gastroesofágico y el síndrome de Zollinger-Ellison. Fue inicialmente comercializado por AstraZeneca como la sal de magnesio, magnesio de omeprazol, con el nombre comercial de Losec® yPrilosec. Actúa sobre las células de la mucosa gástrica, inhibiendo hasta un 80% la secreción de ácido clorhídrico (HCl) mediante la anulación de la salida de protones en la bomba electrogénica H+ / K+.

Uso clínico
El omeprazol con receta se usa para tratar el reflujo gastroesofágico, una afección en la que el flujo retrógrado del contenido gástrico del estómago provoca acidez estomacal y una posible lesión del esófago. El omeprazol permite que la mucosa esofágica cicatrice y previene más lesiones de la misma. También se utiliza para tratar las afecciones en las que el estómago produce demasiado ácido, como el síndrome de Zollinger-Ellison. Además, el omeprazol con receta se utiliza para tratar úlceras (lesiones en el revestimiento del estómago o del intestino), sobre todo las provocadas por un determinado tipo de bacterias (Helicobacter pylori). Sin receta se utiliza para tratar la acidez estomacal frecuente (la que ocurre dos o más veces a la semana).
Uso en la eliminación de Helicobacter pylori
El omeprazol se utiliza en la triple terapia, combinado con los antibióticos claritromicina y amoxicilina (o metronidazol en pacientes hipersensibles a la penicilina) para la eliminación de Helicobacter pylori.1 En el mundo, las infecciones por H. pylori son la principal causa de úlceras, tanto gástricas como duodenales.
Propiedades
Se absorbe rápidamente en el intestino delgado, aunque dicha absorción presenta alguna variabilidad. Su volumen de distribución es bajo: 0,3 L/kg. La biodisponibilidad (dependiendo de la dosis administrada y del pH gástrico), varía entre un 30 y un 70%. Tiene una vida media de 30 a 90 minutos y se excreta principalmente por vía renal, llegando a un 80% en 6 horas. El resto se excreta por vía fecal. La dosis letal (LD) en ratones y ratas es de 1500 mg/kg. Su actividad antisecretora se prolonga hasta 72 horas, y la secreción de ClH va en aumento hasta alcanzar valores normales de 3 a 5 días después de haber suspendido la administración.
Mecanismo
A pH neutro, el omeprazol es una base débil, químicamente estable y carente de actividad inhibitoria. Cuando llega a la célula parietal, a través de la circulación sanguínea, esta base débil queda atrapada en los conductos secretorios. El omeprazol “protonado” se convierte en un ácido sulfénico y una sulfenamida.
La sulfenamida interactúa en sitios cruciales del dominio extracelular de la H+/K+-ATPasa (bomba de protones), inhibiéndola por completo y de manera irreversible. De esta manera no pueden secretarse protones (H+) y se reduce la acidez.
- ESPASMO DIGESTOMEN
Composición
Cada comprimido contiene:
Pancreatina 4 x NF/USP 200 mg
Simeticona 80 mg
Excipientes, c.s.
Pancreatina 4 x NF/USP 200 mg
Simeticona 80 mg
Excipientes, c.s.
Indicaciones
Tratamiento sintomático del meteorismo (exceso de gases) causado por fermentación de los alimentos, dispepsias (mala digestión) por excesos de comida o por déficit de enzimas producidas por el propio organismo (dificiencia pancreática). Las enzimas digestivas ayudan a mejorar la digestión, liberar nutrientes vitales de los alimentos y a mantener una función digestiva saludable.
Posología
1-2 comprimidos antes o durante las principales comidas.
Dosis máxima: 2 comprimidos por toma. 6 comprimidos por día.
Dosis máxima: 2 comprimidos por toma. 6 comprimidos por día.
Precauciones
Si las molestias persisten o se agravan acuda a su médico. No utilizar por más de dos semanas sin consultar al médico. No exceder la dosis recomendada. No administrar junto con ácido fólico.
Contraindicaciones
Hipersensibilidad a alguno de los componentes de la fórmula.
Intoxicación y su tratamiento
La ingestión accidental de un gran número de comprimidos puede provocar diarrea de intensidad moderada que cede en forma espontánea.
Reacciones adversas
Con altas dosis se puede presentar náusea, hinchazón de pies.
Presentación
Caja con 100 comprimidos recubiertos entéricos.
Los medicamentos deben mantenerse fuera del alcance de los niños.
ENZYPRIDE®
- Enzimático - Regulador digestivo y antiflatulentoCOMPOSICION:Cada gragea contiene:Pancreatina............................................................. 400 mg(Corresponde en contenido mínimo por gragea a: Amilasa 11,000 U. FIP,Proteasa 800 U. FIP, Lipasa 12,500 U. FIP).Dimetilpolisiloxano............................................... 60 mgBromopride................................................................... 5 mgINDICACIONES:- Antiemético, antiflatulento, regulador del vaciamiento gástrico o cuando éste semanifiesta debido a deficiencias enzimáticas.- Trastornos de la digestión de proteínas, grasas e hidratos de carbono como consecuencia de insuficiencia excretora del páncreas, especialmente cuando éstos se presentan con aerofagia, meteorismo y flatulencia.RECOMENDACIONES:Por su contenido de Bromopride, la dosificación y administración de en mujeres embarazadas y niños menores de 14 años, deberá ser bajo supervisión médica.ADVERTENCIAS:Puede producir somnolencia, por lo tanto, debe evitarse manejar vehículos y ejecutar actividades que requieran ánimo vigilante.POSOLOGIA:1 ó 2 grageas antes de las comidas.PRESENTACION:Cajas de 20 y 120 grageas.
- 2- CARBOHIDRATOS:
- METFORMINA + GLIBENCLAMIDA
Mecanismo de acción
Metformina + glibenclamidaMetformina: Aumenta significativamente la incorporación de glucosa a lípidos, mejora la eficacia de la utilización de glucosa. Aumenta la síntesis de glucógeno del músculo esquelético sin modificar la síntesis de glucógeno renal o hepático, a través de potenciar las acciones de la insulina endógena. Reduce el p.c. en pacientes obesos, sin modificar el peso de pacientes delgados. Disminuye la hiperglucemia postprandial, ya que aumenta la captura de glucosa por los adipocitos del músculo esquelético, esto posiblemente disminuye el apetito y ayuda a reducir peso en pacientes diabéticos obesos. Disminuye triglicéridos, colesterol total y el LDL-colesterol e incrementa la HDL. Disminuye la glucosa y la insulina plasmática en ayuno, los niveles plasmáticos en la tolerancia total a la glucosa y los niveles plasmáticos de lípidos independientemente de cambios en el p.c.; mejora la tolerancia total a la glucosa, incrementa la captura de glucosa en pacientes obesos y disminuye ligeramente o no modifica ésta en pacientes diabéticos delgados. Disminuye los niveles plasmáticos de glucosa e insulina, aumenta la unión de la insulina a su receptor (en eritrocitos y en adipocitos) La metformina incrementa la velocidad basal del transporte de glucosa, posiblemente a través de incrementar la sensibilidad del transporte a la glucosa. Incrementa la actividad fibrinolítica. Este efecto es producido por una disminución en los niveles plasmáticos del activador inhibidor-1 del plasminógeno. Existe evidencia que señala que la relación entre fibrinólisis deprimida y enf. vascular es debida a niveles altos de y existen razones para creer que la disminución de inhibidor-1 del plasminógeno puede ser benéfica, ya que disminuye también la adherencia de las plaquetas. Glibenclamida: Como toda sulfonilurea, estimula al tejido insular a secretar insulina. Causa degranulación de las células ß, fenómeno asociado a una mayor secreción de insulina. Es ineficaz en los pacientes pancreatectomizados y en los diabéticos insulinodependientes. Durante la administración crónica, los tejidos periféricos se hacen más sensibles a la insulina, debido probablemente a un aumento en el número de receptores para la hormona.Indicaciones terapéuticas
Metformina + glibenclamidaDiabetes mellitus II, no cetoacidósica, en los enfermos que no han respondido positivamente a la monoterapia así como en aquellos con obesidad refractaria cuya hiperglucemia se debe a una acción ineficaz de la insulina.Posología
Metformina + glibenclamida
Oral. Glibenclamida/metformina. Dosis individualizada, sin superar la dosis diaria máx. recomendada de 2 g de metformina y 20 mg de glibenclamida.
Ads.: 2,5mg/500 mg-10/2000 mg/día. Puede ser en una sola toma (comida) o en dos tomas (desayuno y comida). Es conveniente, al inicio del tto., no superar la dosis de metformina o glibenclamida que se había estado tomando previamente.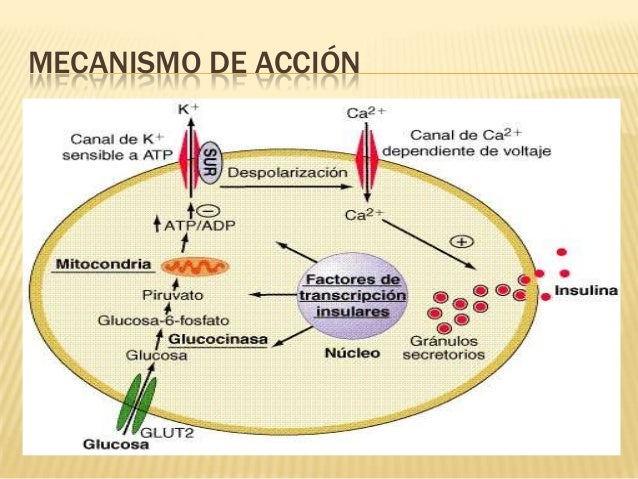


Mecanismo de acción
Vildagliptina
Inhibición rápida y completa de actividad de DPP-4, aumentando así niveles endógenos postprandiales, y en ayunas de hormonas incretinas GLP-1 (péptido 1 similar al glucagón) y GIP (polipéptido insulinotrópico dependiente de glucosa). El aumento de niveles endógenos de hormonas incretinas, potencia sensibilidad a glucosa de células ß, favoreciendo secreción de insulina dependiente de glucosa.
Indicaciones terapéuticas
Vildagliptina
Diabetes mellitus tipo 2 :
Como monoterapia: en pacientes controlados inadecuadamente con dieta y ejercicio solamente y para los que metformina no es adecuado por contraindicaciones/intolerancia.
Como terapia dual en combinación con:
- Metformina, con un control insuficiente de la glucemia a pesar de recibir la dosis máx. tolerada de metformina en monoterapia.
- Sulfonilurea, con un control insuficiente de la glucemia a pesar de recibir la dosis máx. tolerada de una sulfonilurea y para los que metformina no es adecuada por contraindicaciones/intolerancia.
- Tiazolidindiona, con un control insuficiente de la glucemia y para los que es adecuado el uso de una tiazolidindiona.
Como terapia triple con sulfonilurea y metformina cuando, con dieta y ejercicio, no controlan la glucemia adecuadamente.
En combinación con insulina (con o sin metformina) cuando, con dieta y ejercicio, no controla la glucemia adecuadamente.
Como monoterapia: en pacientes controlados inadecuadamente con dieta y ejercicio solamente y para los que metformina no es adecuado por contraindicaciones/intolerancia.
Como terapia dual en combinación con:
- Metformina, con un control insuficiente de la glucemia a pesar de recibir la dosis máx. tolerada de metformina en monoterapia.
- Sulfonilurea, con un control insuficiente de la glucemia a pesar de recibir la dosis máx. tolerada de una sulfonilurea y para los que metformina no es adecuada por contraindicaciones/intolerancia.
- Tiazolidindiona, con un control insuficiente de la glucemia y para los que es adecuado el uso de una tiazolidindiona.
Como terapia triple con sulfonilurea y metformina cuando, con dieta y ejercicio, no controlan la glucemia adecuadamente.
En combinación con insulina (con o sin metformina) cuando, con dieta y ejercicio, no controla la glucemia adecuadamente.
Posología
Vildagliptina
Oral. Ads.:
- En monoterapia o combinación con metformina, con una tiazolidindiona, con metformina + sulfonilurea, o con insulina: 50 mg/12 h (mañana y noche).
- En combinación dual con una sulfonilurea, 50 mg/día por la mañana. Podría requerirse disminuir la dosis de sulfonilurea para reducir riesgo de hipoglucemia.
I.R. grave o moderada o enf. renal terminal: 50 mg 1 vez/día.
- En monoterapia o combinación con metformina, con una tiazolidindiona, con metformina + sulfonilurea, o con insulina: 50 mg/12 h (mañana y noche).
- En combinación dual con una sulfonilurea, 50 mg/día por la mañana. Podría requerirse disminuir la dosis de sulfonilurea para reducir riesgo de hipoglucemia.
I.R. grave o moderada o enf. renal terminal: 50 mg 1 vez/día.
Modo de administración
Vildagliptina
Puede administrarse con o sin alimentos.
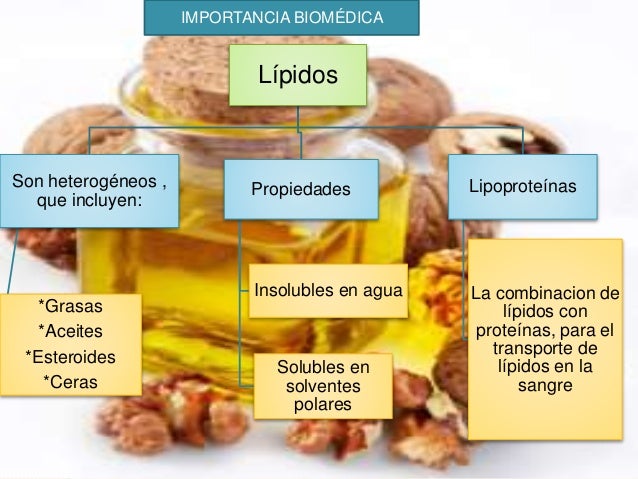
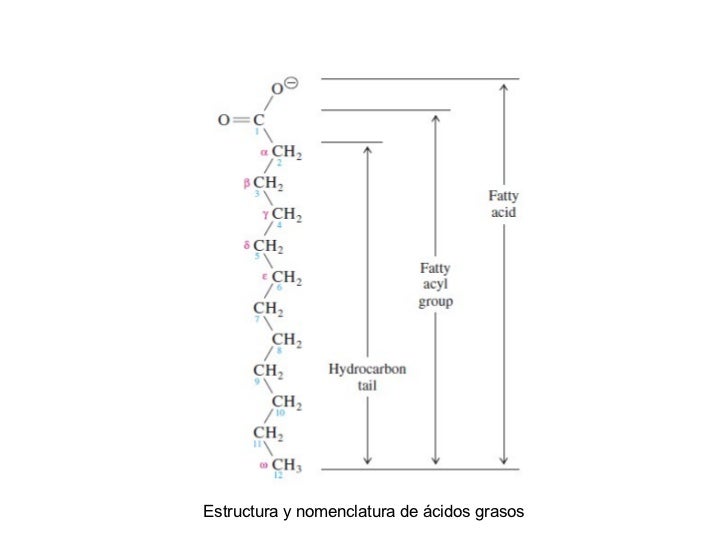
- LÍPIDOS Y MEMBRANA:
SIMVASTATINA:
Mecanismo de acción
Simvastatina
Se hidroliza en el hígado a la forma activa ß-hidroxiácido, potente inhibidor de HMG-CoA reductasa que cataliza la conversión de HMG-CoA en mevalonato, paso inicial y limitante de biosíntesis del colesterol.
Indicaciones terapéuticas y Posología
Simvastatina
Oral. Dosis única: 5-80 mg/día (noche). Ajustar dosis a intervalos mín. de 4 sem; máx. 80 mg/día (noche).
- Hipercolesterolemia 1 aria : inicio: 10-20 mg/día (noche). Si se requiere mayor reducción del C-LDL (más del 45 %): 20-40 mg/día (noche).
- Hipercolesterolemia familiar homocigótica: 40 mg/día (noche) ó 80 mg/día dividido en 3 dosis: 2 dosis de 20 mg y 1 de 40 mg (noche).
- Prevención cardiovascular: 20-40 mg/día (noche).
Niños 10-17 años con hipercolesterolemia familiar heterocigótica: 10 mg/día por la tarde, ajuste de dosis a intervalos de 4 sem o más; máx. 40 mg/día.
En combinación con secuestrantes de ác. biliares administrar > 2 h antes o > 4 h después. Aumenta riesgo de miopatía y rabdomiólisis con: ciclosporina, danazol, gemfibrozilo, otros fibratos (excepto fenofibrato) no exceder de 10 mg/día de simvastatina; con amiodarona o verapamilo no exceder de 20 mg/día de simvastatina; con diltiazem o amlodipino no exceder de 40 mg/día de simvastatina.
I.R. grave (Clcr < 30 ml/min): Advertencias y precauciones con dosis >10 mg/día.
- Hipercolesterolemia 1 aria : inicio: 10-20 mg/día (noche). Si se requiere mayor reducción del C-LDL (más del 45 %): 20-40 mg/día (noche).
- Hipercolesterolemia familiar homocigótica: 40 mg/día (noche) ó 80 mg/día dividido en 3 dosis: 2 dosis de 20 mg y 1 de 40 mg (noche).
- Prevención cardiovascular: 20-40 mg/día (noche).
Niños 10-17 años con hipercolesterolemia familiar heterocigótica: 10 mg/día por la tarde, ajuste de dosis a intervalos de 4 sem o más; máx. 40 mg/día.
En combinación con secuestrantes de ác. biliares administrar > 2 h antes o > 4 h después. Aumenta riesgo de miopatía y rabdomiólisis con: ciclosporina, danazol, gemfibrozilo, otros fibratos (excepto fenofibrato) no exceder de 10 mg/día de simvastatina; con amiodarona o verapamilo no exceder de 20 mg/día de simvastatina; con diltiazem o amlodipino no exceder de 40 mg/día de simvastatina.
I.R. grave (Clcr < 30 ml/min): Advertencias y precauciones con dosis >10 mg/día.
Modo de administración
Simvastatina
Vía oral. Administrar en dosis única por la noche.

LISINOPRIL: Lisinopril
Tabletas
Antihipertensivo
Cada TABLETA contiene:
Lisinopril............................................................................ 10 mg
Excipiente, c.b.p. 1 tableta.
INDICACIONES TERAPÉUTICAS:
LISINOPRIL está indicado en el manejo de la hipertensión media a severa. Se emplea como monoterapia o en combinación con otra clase de agentes antihipertensivos.
CONTRAINDICACIONES:
El medicamento está contraindicado en pacientes con hipersensibilidad conocida al fármaco y en pacientes con historial de angioedema relacionado a un tratamiento previo con inhibidores de la ECA.
PRECAUCIONES GENERALES:
Puede presentarse hipotensión en pacientes hipertensos tratados con LISINOPRIL si tienen una disminución de volumen, debido a estar bajo tratamiento con diuréticos, una dieta pobre en sal, diálisis, diarrea o vómito.
En pacientes con insuficiencia cardiaca congestiva (con o sin insuficiencia renal asociada) se ha presentado hipotensión sintomática, más frecuentemente en aquéllos con grados más severos de insuficiencia cardiaca, probablemente debido al uso de diuréticos de asa, hiponatremia o insuficiencia renal funcional. Este tipo de pacientes tienen un alto riesgo de presentar hipotensión sintomática, por lo que el inicio del tratamiento y el ajuste de la dosis deberán ser monitorizados bajo una estrecha vigilancia médica.
Es importante tener este tipo de consideraciones en aquellos pacientes con cardiopatía isquémica o con enfermedad cerebrovascular, en los que una caída brusca de la presión arterial podría provocarles un infarto del miocardio o un accidente vascular cerebral.
Si se presenta hipotensión, suele ser suficiente colocar al paciente en posición supina y en caso necesario administrar una infusión intravenosa de solu-
ción fisiológica. Una respuesta hipotensora transitoria no es contraindicación para continuar el tratamiento.
LISINOPRIL, como cualquier vasodilatador, debe ser administrado con precaución en pacientes con estenosis aórtica o cardiomiopatía hipertrófica.
En ciertos pacientes con insuficiencia cardiaca y presión arterial normal o baja, el uso de LISINOPRIL puede producir una disminución de la presión arterial sistémica; en el caso de no ser sistémica, no es necesario reducir o suspender el tratamiento. No debe iniciarse el tratamiento en pacientes con infarto agudo del miocardio que estén en riesgo de presentar complicaciones con el uso de un vasodilatador (pacientes con una presión sistólica de 100 mmHg o menos, o pacientes con choque cardiogénico).
La dosis de LISINOPRIL deberá reducirse si durante los primeros tres días después del infarto la presión sistólica es de 120 mmHg o menos.
Los pacientes con insuficiencia cardiaca congestiva que presentan hipotensión al inicio de la administración de un inhibidor de la ECA, pueden presentar algún grado de insuficiencia de la función renal, que habitualmente es irreversible.
También se ha observado que algunos pacientes con estenosis bilateral de las arterias renales o con estenosis de la arteria de un solo riñón, tratados con inhibidores de la ECA, pueden presentar un incremento en los niveles de urea sanguínea y de creatinina sérica reversibles al suspender el tratamiento.
Se han presentado reacciones de tipo anafiláctico en pacientes bajo hemodiálisis con membranas de alto flujo AN 69 y tratamiento concomitante con inhibidores de la ECA, por lo que en estos casos deberá emplearse una membrana de diálisis diferente o emplear un antihipertensivo de otra familia.
En pacientes sometidos a cirugía mayor o durante la anestesia con agentes que produzcan hipotensión, LISINOPRIL puede bloquear la formación de angiotensina II secundaria a la liberación compensatoria de renina y, en caso de presentarse hipotensión, puede corregirse con expansores de volumen.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA:
LISINOPRIL, como cualquier otro inhibidor de la ECA, puede causar morbi-mortalidad fetal y neonatal, principalmente cuando se administran durante el segundo y tercer trimestre del embarazo.Por ello, debe descontinuarse la terapia tan pronto como se tenga conocimiento del embarazo, a menos que al descontinuarse el medicamento se ponga en riesgo la vida de la madre. El uso de LISINOPRIL durante el embarazo también ha sido asociado con hipotensión, falla renal, hipercaliemia e hipoplasia craneal del recién nacido.
No se conoce si el fármaco es excretado en la leche humana.


ÁCIDOS NUCLEICOS:
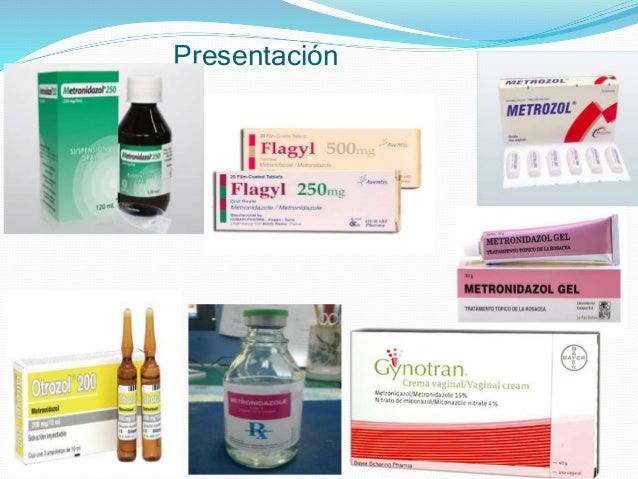
El Metronidazol es un antiinfeccioso antibacteriano y antiparasitario, posiblemente por interacción con el ADN del grupo de los nitroimidazoles. Inhibe la síntesis del ácido nucleico y es utilizado para el tratamiento de las infecciones provocadas por protozoarios y bacterias anaeróbicas. El metronidazol es también indicado como preparación gel para el tratamiento de enfermedades dermatológicas como el acné rosácea. Importante recordar que el metronidazol se debe tomar durante las comidas.
Es importante que, antes de comenzar a tomar Metronidazol tengas en cuenta una serie de aspectos como las que te detallamos a continuación:
Reducir dosis, cuando no estén sometidos a diálisis, y monitorizar nivel sérico de metabolitos. Encefalopatía hepática. Enfermedad aguda o crónica grave del SNC o SNP, riesgo de empeoramiento neurológico. Si es preciso alargar el tratamiento, valorar beneficio/riesgo, realizar determinaciones hematológicas, en especial recuento leucocitario, y vigilar por riesgo de neuropatías central o periférica. Oscurece la orina. Efecto antabús con alcohol, evitar. Evaluar uso en tratamiento prolongado.
El Metronidazol es un medicamento que traspasa la barrera placentaria con lo que hay que valorar el riesgo/beneficio de la aplicación durante el embarazo.
Reacciones del Metronidazol
De entre las reacciones más comunes que pueden derivarse del consumo de Metronidazol, caben destacar las siguientes:
Dolor epigástrico, náuseas, vómitos, diarrea, mucositis oral, trastorno del sabor, anorexia, pancreatitis (reversible), rash, prurito, erupciones pustulares, fiebre, angioedema, shock anafiláctico, neuropatía sensorial periférica, cefalea, convulsiones, vértigo, encefalopatía, síndrome cerebeloso agudo, trastorno psicótico, confusión, alucinación, comportamiento depresivo, trastornos transitorios de la visión, neutropenia, trombocitopenia, alteración reversible de pruebas hepáticas, hepatitis colestática.
Indicaciones terapéuticas y Posología
Este medicamento puede tomarse de distintas maneras, a continuación te detallamos sus usos y la posología indicada:
Oral (durante la comida):
- Uretritis por Trichomonas
- Uretritis y vaginitis por Trichomonas
- Lambliasis
- Amebiasis intestinal y hepática
- Infección por anaerobios
- Infección por bacterias anaerobias: Bacterioides, Fusobacterias, Eubacterias, Clostridium, Estreptococos anaerobios
- Prevención de infección postoperatoria por bacterias anaerobias, especialmente Bacteroides y Estreptococos.

RIFAMPICINA
La rifampina se utiliza en el tratamiento de la tuberculosis, siendo considerada como fármaco de primera elección, si bien no debe utilizarse en solitario debido a que rápidamente se desarrollan resistencias. También se utiliza para tratar portadores asintomáticos de la Neisseria meningitidis, como profiláctico frente al H. influenzae tipo B, y en el tratamiento de la lepra. También es eficaz en las infecciones por Legionella, estafilococos y micobacterias atípicas
Mecanismo de acción: la rifampina se une a la subunidad beta de la DNA-polimeradasa RNA-dependiente, impidiendo que esta enzima se una al DNA, bloqueando la transcripción del RNA. La rifampina no se une a las polimerasas de las células eucarióticas de tal manera que la síntesis del RNA humano no es afectada. La rifampina es bacteriostática o bactericida según las concentraciones que alcance en su lugar de acción y de la susceptibilidad del microorganismo. La rifampina es eficaz frente a microorganismos en fase de división rápida en las lesiones cavitarias y también frente a los que se dividen lentamente, como los que se encuentran en las lesiones caseosas y en los macrófagos. En general, los siguientes microorganismos son sensibles a la rfampina: Mycobacterium tuberculosis; M. bovis; M. kansasii; M. marinum; M. leprae; y algunas cepas de M. avium, M. intracellulare,y M. fortuitum. La rifampina es extremadamente activa frente a Neisseria meningitidis, Staphylococcus aureus, Haemophilus influenzae, y Legionella pneumophila. También posee una cierta efectividad, aunque a concentraciones muy elevadas, frente a Chlamydia trachomatis, poxvirus, y adenovirus.
La rifampina induce la actividad enzimática microsomal aumentando el metabolismo y la excreción urinaria de los ácidos biliares y ha sido utilizada para aliviar el prurito secundario a la colestasis asociada a la cirrosis biliar.
Farmacocinética: la rifampina se administra por oral e intravenosa. Después de la administración de una dosis oral, la rifampina se absorbe rápidamente, alcanzando los máximos niveles en sangre a las 2-4 horas. Los alimentos afectan tanto la rapidez como la extensión de la absorción. El fármaco se distribuye muy bien en la mayoría de los órganos y tejidos incluyendo los pulmonares, el hígado, el hueso, saliva y los fluídos peritoneal y pleural.